
新華社北京1月23日電 中共中央總書記、國家主席、中央軍委主席、中央全面深化改革領(lǐng)導(dǎo)小組組長習(xí)近平1月23日下午主持召開中央全面深化改革領(lǐng)導(dǎo)小組第二次會議并發(fā)表重要講話。他強調(diào),2018年是貫徹黨的十九大精神的開局之年,也是改革開放40周年,做好改革工作意義重大。要弘揚改革創(chuàng)新精神,推動思想再解放改革再深入工作再抓實,凝聚起全面深化改革的強大力量,在新起點上實現(xiàn)新突破。
會議指出,改革完善仿制藥供應(yīng)保障及使用政策,要從群眾需求出發(fā),把臨床必需、療效確切、供應(yīng)短缺、防治重大傳染病和罕見病、處置突發(fā)公共衛(wèi)生事件、兒童用藥等作為重點,促進(jìn)仿制藥研發(fā)創(chuàng)新,提升質(zhì)量療效,提高藥品供應(yīng)保障能力,更好保障廣大人民群眾用藥需求。
CDE 認(rèn)定符合條件的藥物進(jìn)行梳理:
1.臨床必需、供應(yīng)短缺藥物(7 個)
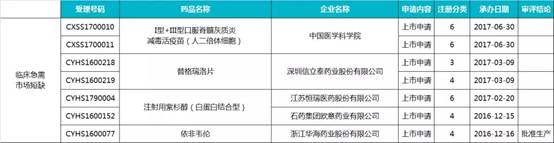
2. 防治重大傳染病藥物(2 個)

3.防治罕見病藥物(6 個)
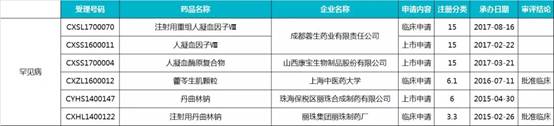
4.兒童用藥藥物(15 個)
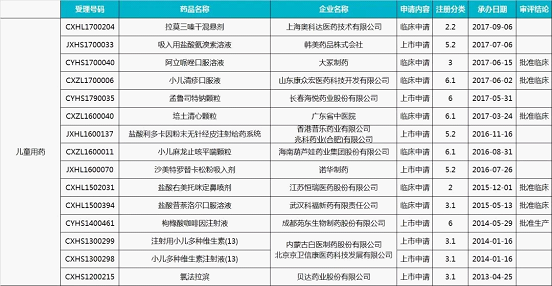
對于還未批準(zhǔn)上市的臨床急需品種,會有相應(yīng)的政策加快審批。
CFDA 后續(xù)會持續(xù)優(yōu)化對于這部分臨床急需藥品的審評審批程序,在滿足一定條件的基礎(chǔ)上加速上市,從而降低企業(yè)研發(fā)成本。
對于已經(jīng)批準(zhǔn)上市的臨床急需藥物,會有相應(yīng)的政策給與優(yōu)待。
會通過進(jìn)入醫(yī)保目錄、招標(biāo)中標(biāo)、患者的報銷比例等等措施,最大程度提升企業(yè)藥品上市后的回報。
一些列政策的推出映證著 CFDA 對優(yōu)先審評工作的重視程度。CFDA 在努力做好自身工作,加快向市場輸送臨床急需仿制藥的速度。
同時,也在用政策利好來吸引企業(yè)關(guān)注,呼吁更多的企業(yè)加入研發(fā)臨床急需藥物的行列。最終的目的總是一致的,讓老百姓能真正“用得上藥”“用得起藥”。